Gleichzeitig ist mit dem Auftreten einer Thrombose eine deutlich schlechtere Prognose verbunden, da die erhöhte Gerinnungsaktivität anscheinend die Metastasierung fördert. Umgekehrt können Thrombosen auf einen nicht erkannten Tumor hinweisen, nachdem eine Studie überraschend zeigte, dass sich in jedem fünften Patienten mit einer Thrombose unbekannter Ursache (idiopathische Thrombose) ein Tumor verbirgt.
Ein direkter Zusammenhang zwischen der Blutgerinnung und der Ausbreitung eines Tumors ist daher evident. Bislang ist aber der Mechanismus, der Gerinnungsaktivität und Tumorprogression (Metastasierung) miteinander verbindet, nicht geklärt. Wissenschaftler der Sektion Experimentelle Dermatologie an der Medizinischen Fakultät Mannheim der Universität Heidelberg sind diesem Mechanismus auf der Spur. Ihre aktuellen Forschungsergebnisse zu dieser Fragestellung bilden das „Issue Highlight“ und schmücken das Cover der aktuellen Ausgabe der renommierten Fachzeitschrift Blood.
Krebszellen initiieren die Gerinnung
Die Hypothese, die dem Forschungsansatz des Mannheimer Teams um Sektionsleiter Professor Dr. Stefan Werner Schneider zugrunde liegt: Der Tumor aktiviert sehr früh das Gerinnungssystem und macht sich dieses bei der Metastasierung zunutze. Denkbar wäre, dass die Tumorzellen das Gerinnungssystem quasi als Anker nutzen, um am Endothel der Gefäßinnenwand anzudocken und in der Folge in das Gewebe einzuwandern.
Mithilfe von Zellkulturen haben die Wissenschaftler untersucht, ob und wie Krebszellen mit dem Endothel kommunizieren. Sie konnten nachweisen, dass Melanomzellen tatsächlich humane Endothelzellen aktivieren und diese daraufhin die Gerinnung initiieren. Dies wird mittels Freisetzung des von Willebrand Faktors (VWF), eines essentiellen Gerinnungsmoleküls, ermöglicht. Der VWF bildet nach seiner Freisetzung ein hoch-adhäsives fadenförmiges Netzwerk, das unmittelbar Blutplättchen bindet und aktiviert.
Marcumar ist in einigen Fällen wirkungslos
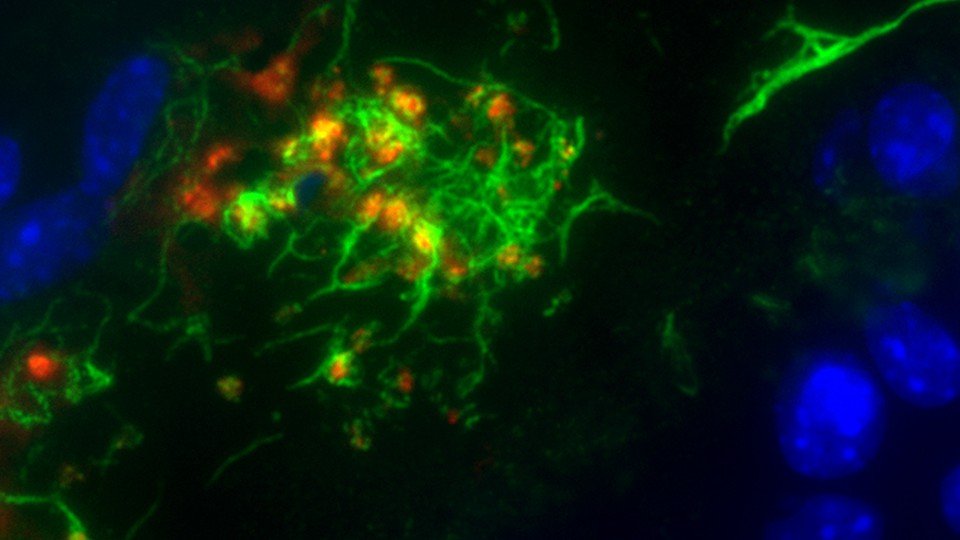
In der Zellkultur, wie auch in einem Melanom-Mausmodell, konnten sie innerhalb von Sekunden nach der Aktivierung des Endothels durch maligne Tumorzellen kleinste Blutgerinnsel (Mikrothromben bestehend aus VWF und Blutplättchen; siehe Abbildung) nachweisen. Diese Mikrothromben lassen sich auch in Metastasen von Melanompatienten nachweisen. Als Hauptmediator der tumorvermittelten Endothelzellaktivierung wurde das Wachstumshormon VEGF‑A (Vascular Endothelial Growth Factor A) identifiziert.
Interessanterweise erklärt diese Arbeit auch, warum das gerinnungshemmende Medikament Marcumar® bei der Mehrzahl der Tumorpatienten mit einer Thrombose oder Lungenembolie nicht ausreichend anschlägt. Marcumar® ist ein Antagonist von Vitamin K, der der Thrombose entgegenwirkt, indem er die Fibrinbildung verhindert. Fibrin ist ein Bestandteil der plasmatischen Gerinnung, die über die Vernetzung der Blutplättchen essentiell zur Blutstillung beiträgt. Die Mikrothromben (bestehend aus VWF und Blutplättchen), die sich nach Aktivierung des Endothels durch Tumorzellen bilden, unterscheiden sich jedoch von dem Fibringerinnsel. Daher sind die Vitamin K Antagonisten hier nahezu wirkungslos.
Tumorpatienten sollten mit Heparin behandelt werden
Eine wichtige Konsequenz dieser Forschungsergebnisse: Es empfiehlt sich, Tumorpatienten zur Prophylaxe und Therapie von Thrombosen und Embolien dauerhaft (mindestens 6 Monate) mit einem niedermolekularen Heparin zu behandeln. Dieser Wirkstoff entfaltet seine Wirkung nicht nur indem er die Fibrinsynthese hemmt. Er verhindert darüber hinaus die tumorinduzierte Freisetzung von VWF und damit auch die Mikrothrombosierung.